En un trabajo reciente, publicado por el grupo del Dr. José A. Hernández en cooperación con el Dr. Abel Piqueras, se ha comprobado que las enzimas antioxidantes, la fluorescencia de clorofila y los niveles de peroxidación lipídica (un parámetro de estrés oxidativo) pueden ser herramientas adecuadas para la evaluación del estado fisiológico de plantas micropropagadas de stevia durante la aclimatación a condiciones ex vitro. Estos parámetros proporcionan información muy útil para monitorizar el estado de estrés de las plantas durante el proceso de aclimatación Este trabajo tiene implicaciones prácticas, ya que las plantas clonales de stevia con un perfil conocido y estable de esteviol glucósidos son una fuente adecuada para la producción de edulcorantes y antioxidantes naturales para la dieta.

Fases de la aclimatación de las plantas de stevia. A: Multiplicación; B: Enraizamiento: C: 2 dias aclimatación; D: 2 semanas aclimatación; E: 4 semanas aclimatación
Introducción
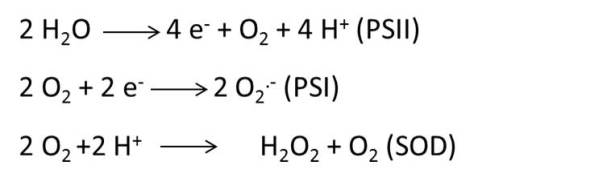
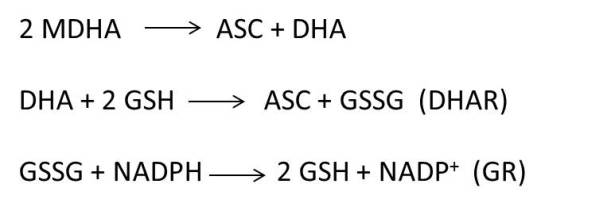
La aplicación de técnicas de cultivo in vitro es una poderosa herramienta de proliferación vegetativa para muchas especies vegetales [Van-Huylenbroeck et al 2000]. Sin embargo, este proceso puede limitarse debido a pérdidas significativas durante la aclimatación a condiciones ex vitro. La mejora de la actividad fotosintética es un paso crítico para alcanzar una alta tasa de supervivencia durante la aclimatación de las plántulas in vitro [Carvalho et al 2001]. En otras palabras, la activación adecuada de la fotosíntesis es el punto clave para cambiar la forma de adquirir carbono de fuentes heterotróficas o mixotróficas (condiciones in vitro) a fuentes autotróficas (condiciones ex vitro). Las plantas micropropagadas son muy susceptibles a las condiciones ambientales después de la transferencia a condiciones ex vitro. Por ejemplo, las plantas ex vitro normalmente están expuestas a una mayor intensidad luminosa que las plantas cultivadas en condiciones in vitro. Además, la humedad relativa (HR) también es menor en condiciones ex vitro, por lo que las plantas son propensas a sufrir desecación durante la aclimatación. Ambos fenómenos, que contribuyen al daño por fotoinhibición y al estrés hídrico, pueden inducir la sobreproducción de especies reactivas de oxígeno (ROS). Sin embargo, las plantas cuentan con un mecanismo eficiente de defensa antioxidante para defenderse de los efectos nocivos de ROS. Estas defensas incluyen las enzimas del ciclo ascorbato-glutatión (ASC-GSH) (ascorbato peroxidasa (APX), monodehidroascorbato reductasa (MDHAR), deshidroascorbato reductasa (DHAR) y glutatión reductasa (GR)) y enzimas captadoras de ROS (superóxido dismutasas (SOD), peroxidasas (POX) y catalasa (CAT). El conocimiento sobre el comportamiento de la maquinaria antioxidante durante la aclimatación ex vitro es muy escaso, y solo unos pocos investigadores han estudiado los cambios en los antioxidantes enzimáticos y no enzimáticos durante este proceso [Van-Huylenbroeck et al 2000; Carvalho et al 2006; Dewir et al 2015; El-Mahrouk et al 2016].
La stevia (Stevia rebaudiana Bertoni) es un arbusto perenne perteneciente a la familia Asteraceae. Las hojas de S. rebaudiana contienen una alta concentración de esteviol glucósidos, siendo las formas prevalentes el esteviósido y el rebaudiósido A, empleados como edulcorantes naturales como sustitutos de la sacarosa [Zeng et al 2006]. Sin embargo, las semillas de stevia tienen poca viabilidad y la planta requiere condiciones específicas de humedad, luz y nutrientes. La acumulación de esteviol glucósidos en S. rebaudiana es muy variable debido a la variabilidad genética. El contenido total de esteviol glucósidos es diferente no solo entre plantas del mismo cultivar, sino también entre plantas similares en la misma etapa de desarrollo [Ceunen et al 2007]. Además, se ha observado una alta capacidad antioxidante de los extractos de hojas de S. rebaudiana, relacionados con su función como captadores de ROS [Ceunen et al 2007; Ghanta et al 2007). Estas funciones positivas se han asociado principalmente con la presencia de compuestos fenólicos [Ceunen et al 2007]. Además, se han descritos efectos positivos del esteviósido relacionados con la diabetes tipo II, la hipertensión, el síndrome metabólico y la aterosclerosis [Ceunen et al 2007]. Por lo tanto, la producción de plantas clonales in vitro con un perfil de esteviósido similar puede ser de interés comercial.
En consecuencia, este trabajo se ha centrado en la aclimatación a las condiciones ex vitro de clones de stevia, originada a partir de la micropropagación de plantas previamente caracterizadas como altos acumuladores de esteviol glucósidos [Cantabella et al 2017]. Durante el proceso de aclimatación, se siguió la evolución de diferentes parámetros, incluido el metabolismo antioxidante, la peroxidación lipídica como parámetro de estrés oxidativo y la fluorescencia de clorofila, para determinar el estrés oxidativo que las plantas de stevia podrían estar sufriendo durante el proceso antes mencionado.
Resultados y Discusión
Durante las primeras horas del proceso de aclimatación, las plantas de stevia parecían experimentar estrés debido a la modificación de las condiciones de cultivo, como se observa por el aumento en los niveles de peroxidación lipídica, medidos como TBARS. En ese sentido, se detectó un pico después de 2 días, aumentando en un 86% con respecto a los valores en la plántula (Figura 1). Posteriormente, y a medida que avanzaba el proceso de aclimatación a las condiciones ex vitro, los valores de peroxidación lipídica disminuyeron progresivamente hasta alcanzar los valores iniciales (Figura 1). Por lo tanto, se produjo un estrés oxidativo durante las primeras horas de aclimatación, indicando un posible daño a las membranas como consecuencia del cambio de condiciones de cultivo.

Fig 1. Datos de peroxidación de lípidos durante la aclimatación de plantas de stevia
Respecto al comportamiento de las enzimas antioxidantes, observamos una actividad menor de la enzima monodehidroascorbato reductasa (MDHAR) que la enzima dehidroascorbato reductasa (DHAR) después de 2 días de aclimatación. Sin embargo, después de 7 días de aclimatación, las plantas de stevia activaron la ruta MDHAR para reciclar el ascorbato, que es mucho más eficiente, desde un punto de vista energético, que la ruta DHAR (Figura 2).
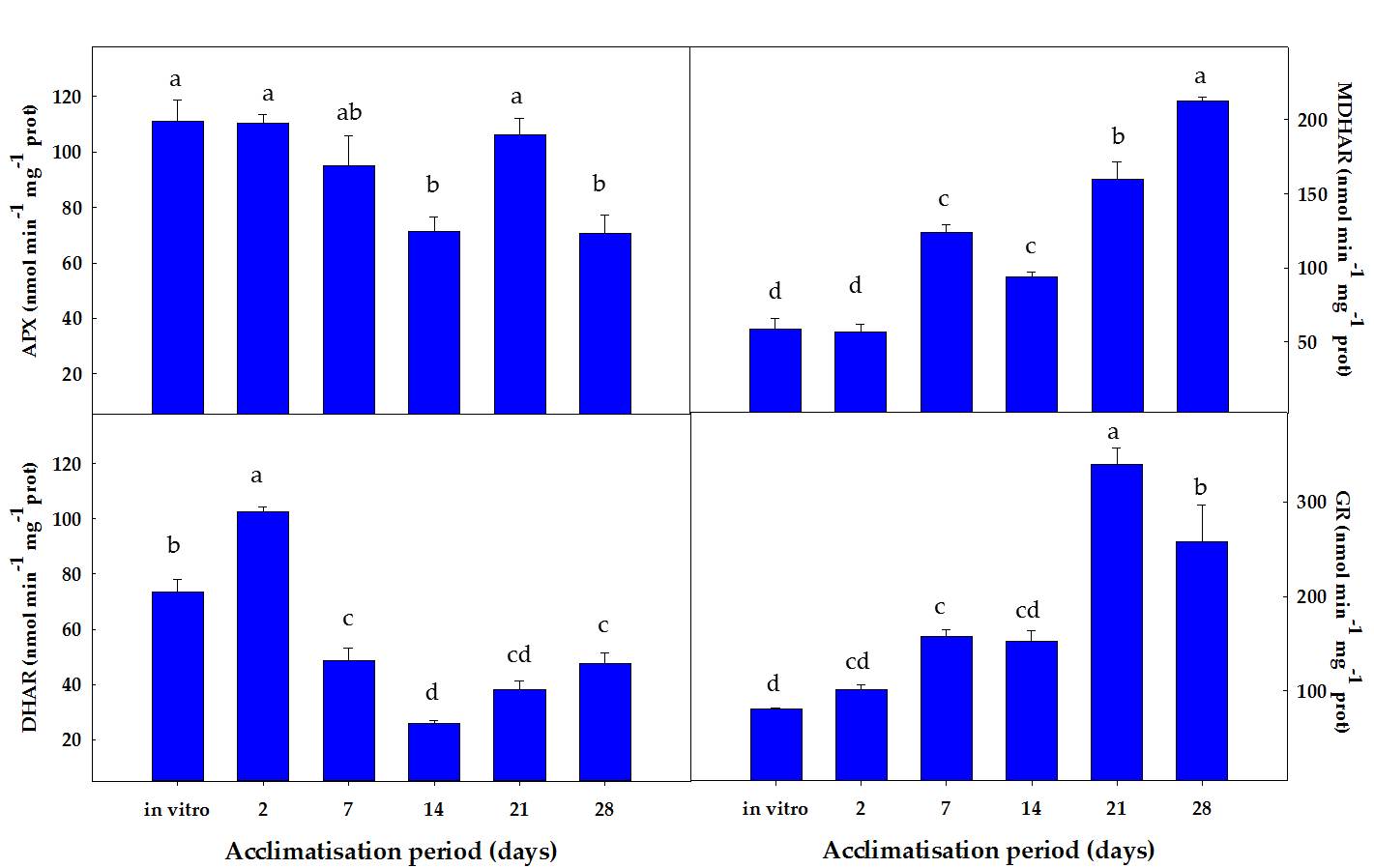
Figura 2. Evolución de las enzimas del ciclo ASC-GSH durante el procesod e aclimatación de plantas de stevia
En ese sentido, después de 2 días de aclimatación, la relación DHAR / MDHAR era casi 2. Esto sugiere que, en esa etapa, la actividad de DHAR era la vía predominante en el reciclaje de ascorbato en plantas de stevia, utilizando GSH como donante de electrones. Posteriormente, DHAR disminuyó y MDHAR aumentó progresivamente, alcanzando una relación DHAR / MDHAR de 0.22 después de 28 días de aclimatación, donde la actividad de MDHAR fue casi 5 veces mayor que la actividad de DHAR. Por lo tanto, después de 2 días de aclimatación, las plantas de stevia utilizaron la forma MDHAR, empleando NADH como poder reductor. Es necesario aclarar que la utilización de NADH para reciclar el ASC es más eficiente energéticamente que el uso de GSH. Por lo tanto, se pueden especular diferentes posibilidades para explicar la mayor actividad de DHAR en condiciones in vitro y después de 2 días de aclimatación. La primera es que, en condiciones in vitro, los medios de cultivo contenían sacarosa, por lo que las plantas tenían suficiente fuente de carbono para generar energía a través de la glucólisis y de la respiración, y por lo tanto pueden permitirse el uso de GSH para reciclar ASC (la “forma ineficiente”). La segunda posibilidad es que después de 2 días del proceso de aclimatación, las plantas sufrieron un estrés oxidativo, según los datos de peroxidación lipídica. Dado que la sobreexpresión de DHAR se ha asociado con la tolerancia al estrés ambiental [Eltayeb et al 2006], la mayor actividad de DHAR observada en esta etapa podría tener una función para hacer frente al estrés resultante de las condiciones de aclimatación. La tercera explicación está relacionada con el papel de DHAR en el crecimiento y desarrollo de las plantas [Potters et al 2012]. Probablemente, después de 2 días de aclimatación, el aumento de DHAR podría tener una función en los procesos de crecimiento y desarrollo de las plantas. También observamos que la actividad de MDHAR aumentó después de 7 días de aclimatación. En esta etapa, la fotosíntesis parecía funcionar correctamente, como lo observan los valores de fluorescencia de clorofila y ETR. Por lo tanto, a partir de ese momento, las plantas produjeron sus propios azúcares y energía para apoyar el crecimiento de las plantas. Probablemente, por esta razón, las plantas cambiaron la forma de reciclar el ascorbato de una manera eficiente, a través de NADH.
La actividad GR se comportó de manera similar a la actividad MDHAR. En ese sentido, GR aumentó a medida que avanzó el proceso de aclimatación de las plantas, alcanzando sus valores máximos después de 21 y 28 días de aclimatación (incrementos de 4.2 y 3.2 veces, respectivamente) (Figura 2).
Las actividades superóxido dismutasa (SOD) y catalasa (CAT) mostraron un pico de actividad después de 7 días de aclimatación (Figura 3), lo que sugiere una protección contra las ROS (especies reactivas de oxígeno) que se podrían estar generando como consecuencia del cambio de cultivo in vitro a ex vitro. La actividad peroxidasa (POX) aumentó aproximadamente 2 veces después de 2 días de aclimatación y permaneció alta hasta el día 14 (Figura 3), probablemente relacionada con el endurecimiento de la pared celular y los procesos de lignificación.

Figura 3. Evolución de las enzimas SOD, CAT y POX durante el proceso de aclimatación de plantas de stevia
Después de 2 días de aclimatación, las plantas mostraron valores más altos de los parámetros de quenching no fotoquímico [Y (NPQ), Y (NO), NPQ y qN] y valores bajos de los parámetros de quenching fotoquímico [Y (II), qP] (Figura 4), así como de la velocidad de transporte de electrones (ETR) (Figura 5). Durante el proceso de aclimatación, se observó una disminución progresiva en los parámetros de quenching no fotoquímicos y un aumento constante en los parámetros de quenching fotoquímico. En ese sentido, Y (NPQ) disminuyó progresivamente, reduciendo sus valores en un 40% y 50% después de 21 y 28 días de aclimatación, respectivamente (Figura 4). Paralelamente, Y (NO) disminuyó durante el ensayo de aclimatación, alcanzando una disminución cercana al 40% y 30% después de 21 y 28 días de aclimatación, respectivamente (Figura 4). NPQ muestra aumentos y disminuciones durante el proceso de aclimatación. Al principio, después de 7 días de aclimatación, este parámetro aumentó en un 22%. Luego, el valor NPQ aumentó en un 63% después de 14 días de aclimatación en relación con el valor precedente (día 7). Una semana después (día 21), nuevamente el valor NPQ aumentó en un 29% en comparación con el valor observado en la segunda semana (14 días). Finalmente, después de 28 días de aclimatación, se observó una disminución del 30% en el parámetro NPQ en relación con el valor observado después de 21 días (Fig. 4). Sin embargo, aunque los valores de qN disminuyeron durante el proceso de aclimatación, los cambios producidos no fueron estadísticamente significativos (Figura 4). Tanto NPQ como Y (NPQ) están relacionados con la energía disipada como calor por un mecanismo regulado (es decir, el ciclo de xantofila) [Zhang et al 2012]. En contraste, Y (NO) refleja la fracción de energía disipada pasivamente como calor y fluorescencia, principalmente debido a los centros de reacción del PSII cerrados. Por lo tanto, los valores altos de Y (NO) están relacionados con la incapacidad de las plantas para protegerse del exceso de luz. En ese sentido, después de 2 días de aclimatación, las plantas de stevia mostraron los valores más altos de Y (NO), que disminuyeron progresivamente durante el proceso de aclimatación, lo que refleja una mejor regulación [Klughammer et al 2008]. Por otro lado, valores altos de los parámetros de quenching no fotoquímicos indicaban que las plantas estaban sufriendo un estrés. Sin embargo, a medida que la planta se adaptaba a las nuevas condiciones ex vitro, estos parámetros disminuyeron.
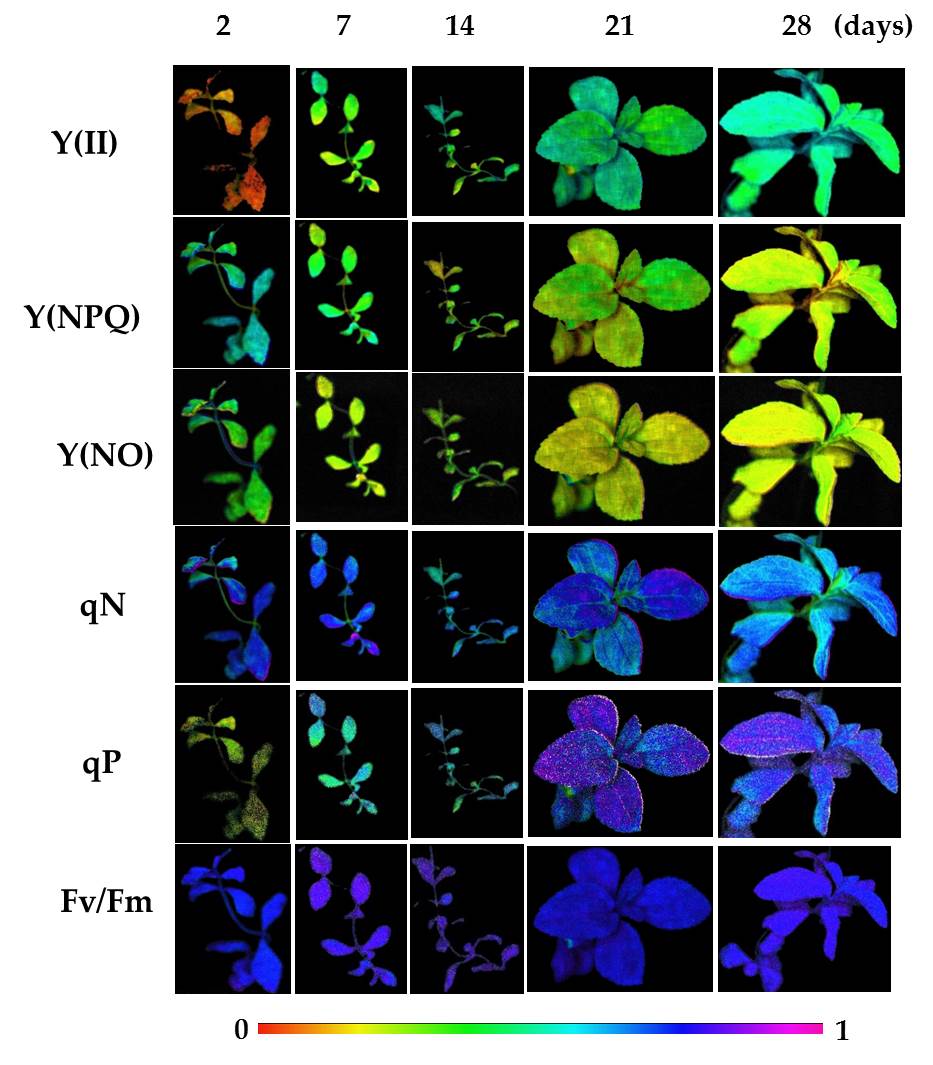
FIgura 4. Evolución de los parámetros de fluorescencia de clorofilas durante el proceso de aclimatación de plantas de stevia
Con respecto a los parámetros de quenching fotoquímico (Y (II) y qP), se produjo un aumento progresivo durante la aclimatación. En ambos casos, los valores aumentaron cerca de 3 veces después de 7 y 14 días de aclimatación, y aproximadamente 5 veces después de 21 y 28 días del proceso (Figura 4). Fv / Fm mostró los valores más bajos después de 2 días de aclimatación. Este parámetro aumentó después de 7 y 14 días, y luego disminuyó ligeramente después de 21 y 28 días de aclimatación, pero sus valores permanecieron estadísticamente más altos que los valores iniciales (Tabla 1). Los cambios observados en Y (II) y qP se correlacionaron con la evolución de los valores de ETR, alcanzando un aumento de casi 6 veces al final (28 días) del proceso de aclimatación (Figura 5). Esta respuesta de los parámetros de fluorescencia de clorofilas indicaba una mayor eficiencia fotosintética conforme avanzaba el proceso de aclimatación a las condiciones ex vitro.

Figura 5. Evolución de la tasa de transporte electrónico durante el proces de aclimatación de plantas de stevia
Conclusiones
En conjunto, los datos sugirieron que las enzimas antioxidantes, la peroxidación lipídica y los parámetros de fluorescencia de clorofila pueden ser herramientas adecuadas para la evaluación del estado fisiológico de las plantas micropropagadas durante la aclimatación a condiciones ex vitro de plantas de stevia, proporcionando información muy útil para controlar el estado de estrés de las plantas durante el proceso de aclimatación. Este trabajo tiene implicaciones prácticas, ya que las plantas clonales de stevia con un perfil conocido y estable de esteviol glucósidos son una fuente adecuada de edulcorantes y antioxidantes naturales para una dieta sana.
Para más información:
José Ramón Acosta-Motos, Laura Noguera Vera, Gregorio Barba-Espín, Abel Piqueras, José A. Hernández (2019) Antioxidant metabolism and chlorophyll fluorescence during the acclimatisation to ex vitro conditions of micropropagated Stevia rebaudiana Bertoni plants. Antioxidants, Special Issue “Antioxidants and Foods”, 8, 615. (https://www.mdpi.com/2076-3921/8/12/615)
Bibliografía
Cantabella, D.; Piqueras, A.; Acosta-Motos, J.R.; Bernal-Vicente, A.; Hernandez, J.A.; Diaz-Vivancos, P. Salt-tolerance mechanisms induced in Stevia rebaudiana Bertoni: effects on mineral nutrition, antioxidative metabolism and steviol glycoside content. Plant Physiol. Biochem. 2017, 115, 484–496.
Carvalho, L.C.; Osorio, M.L.; Chaves, M.M.; Amâncio S. Chlorophyll fluorescence as an indicator of photosynthetic functioning of in vitro grapevine and chestnut plantlets under ex vitro acclimatization. Plant Cell Tissue Organ Cult. 2001, 67, 271–280.
Carvalho, L.C.; Vilela, B.J.; Vidigal, P.; Mullineaux, P.M.; Amâncio, S. Activation of the ascorbate-glutathione cycle is an early response of micropropagated Vitis vinifera L. explants transferred to ex vitro. Int. J. Plant Sci. 2006, 167, 759-770.
Ceunen, S.; Geuns, J.M.C. Steviol Glycosides: Chemical Diversity, Metabolism, and Function. J. Nat. Prod. 2013, 76, 1201−1228.
Dewir, Y.H.; El-Mahrouk, M.E.; Al-Shmgani, H.S.; Rihan, H.Z.; Teixeira da Silva, J.A.; Fuller, M.P. Photosynthetic and biochemical characterization of in vitro-derived African violet (Saintpaulia ionantha H. Wendl) plants to ex vitro conditions. J. Plant Interact. 2015, 10, 101-108.
El-Mahrouk, M.E.; Dewir, Y.H.; Murthy, H.N.; Rihan, H.Z.; Al-Shmgani, H.S.; Fuller, M.P. Effect of photosynthetic photon flux density on growth, photosynthetic competence and antioxidant enzymes activity during ex vitro acclimatization of Dieffenbachia cultivars. Plant Growth Regul. 2016, 79, 29–37.
Eltayeb, A.E.; Kawano, N.; Badawi, G.H.; Kaminaka, H.; Sanekata, T.; Morishima, I.; Shibahara, T.; Inanaga, S.; Tanaka, K. Enhanced tolerance to ozone and drought stresses in transgenic tobacco overexpressing dehydroascorbate reductase in cytosol. Physiol. Plant. 2006, 127, 57–65.
Ghanta, S.; Banerjee, A.; Poddar, A.; Chattopadhyay, S. Oxidative DNA Damage Preventive Activity and Antioxidant Potential of Stevia rebaudiana (Bertoni) Bertoni, a Natural Sweetener. J. Agr.Food Chem. 2007, 55, 10962-10967.
Klughammer, C.; Schreiber, U. Complementary PSII quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the saturation pulse method. PAM Application Notes (PAN) 2008, 1, 27-35
Potters, G.; Horemans, N.; Caubergs, R.J.; Asard, H. Ascorbate and dehydroascorbate influence cell cycle progression in a tobacco cell suspension. Plant Physiol. 2012, 124, 17-20.
Van-Huylenbroeck, J.M.; Piqueras, A.; Debergh, P.C. The evolution of photosynthetic capacity and the antioxidant enzymatic system during acclimatization of micropropagated Calathea plants. Plant Sci. 2000, 155, 59-66.
Zeng, J.; Cheng, A.; Lim, D.; Yi, B.; Wu, W. Effects of salt stress on the growth, physiological responses, and glycoside contents of Stevia rebaudiana Bertoni. J. Agric. Food Chem. 2013, 61, 5720-5726.
Zhang, Q.Y.; Wang, L.Y.; Kong, F.Y.; Deng, Y.S.; Li, B.; Meng, Q.W. Constitutive accumulation of zeaxanthin in tomato alleviates salt stress-induced photoinhibition and photooxidation. Physiol. Plant. 2012, 146, 363–373.
















 José A. Hernández es Investigador Científico del Grupo de Biotecnología de Frutales (CEBAS-CSIC)
José A. Hernández es Investigador Científico del Grupo de Biotecnología de Frutales (CEBAS-CSIC)